Zn(OH)2 + HCl → ZnCl2 + H2O – VietJack.com
Chào mừng bạn đến với pgdgiolinhqt.edu.vn trong bài viết về Znoh2 hcl zncl2 h2o chúng tôi sẽ chia sẻ kinh nghiệm chuyên sâu của mình cung cấp kiến thức chuyên sâu dành cho bạn.
Phản ứng Zn(OH)2 + HCl → ZnCl2 + H2O
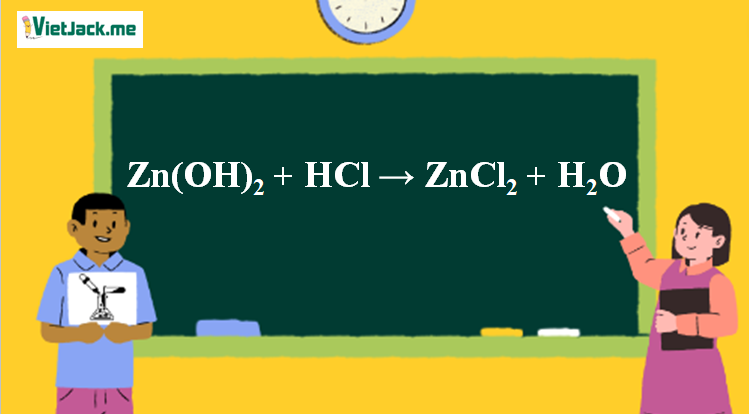
1. Phương trình phản ứng Zn(OH)2 tác dụng NaOH
2. Phương trình ion rút gọn Zn(OH)2 + HCl
Phương trình ion rút gọn:
Zn(OH)2 + 2H+ → Zn2+ + 2H2O
3. Điều kiện phản ứng Zn(OH)2 tác dụng HCl
Không có
4. Hiện tượng phản ứng Zn(OH)2 tác dụng HCl
Đem hòa tan vào dung dịch HCl dư, thấy chất rắn tan dần.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của Zn(OH)2 (Kẽm hidroxit)
Zn(OH)2 là hidroxit lưỡng tính tác dụng được với axit.
5.2. Bản chất của HCl (Axit clohidric)
HCl là một axit mạnh tác dụng được với Zn(OH)2.
6. Mở rộng kiến thức về Zn(OH)2
6.1. Tính chất vật lí & nhận biết
– Tính chất vật lí: Là chất bột, màu trắng, không tan trong nước, nóng chảy ở 125oC.
– Nhận biết: Hòa tan Zn(OH)2 trong dung dịch NaOH đặc, thấy chất rắn tan dần:
2NaOH + Zn(OH)2→ Na2ZnO2 + 2H2O
6.2. Tính chất hóa học
Mang tính chất của hiđroxit lưỡng tính.
Phản ứng với axit
Zn(OH)2 + 2HCl → ZnCl2 + 2H2O
Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O
Hòa tan trong kiềm đặc và trong amoniac
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O
Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2
Nhiệt phân:
Zn(OH)2 ZnO + H2O
Zn(OH)2 còn tác dụng với các axit hữu cơ như:
2CH3COOH + Zn(OH)2 → (CH3CCO)2Zn + 2H2O
6.3. Điều chế
Kẽm hiđroxit có thể được điều chế bởi phản ứng kẽm clorua hay kẽm sunfat với natri hiđroxit vừa đủ:
ZnCl2 + 2NaOH → 2NaCl + Zn(OH)2↓
ZnSO4 + 2NaOH → Na2SO4 +Zn(OH)2↓
7. Tính chất hóa học của HCl
Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
7.1. Tác dụng chất chỉ thị
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl-
7.2. Tác dụng với kim loại
Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Fe + 2HCl FeCl2 + H2
2Al + 6HCl 2AlCl3 + 3H2
Cu + HCl → không có phản ứng
7.3. Tác dụng với oxit bazo và bazo
Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl CuCl2 + H2 O
Fe2 O3 + 6HCl 2FeCl3 + 3H2 O
7.4. Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng để nhận biết gốc clorua )
Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2 MnCl2 + Cl + 2H2 O
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan ( cường thuỷ) có khả năng hoà tan được Au ( vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
8. Bài tập vận dụng liên quan
Câu 1. Dãy các hợp chất nào sau đây tan được trong nước nhưng không tan trong nước
A. CuS, Ca3(PO4)2, CaCO3.
B. AgCl, BaSO3, Cu(OH)2.
C. BaCO3, Fe(OH)3, FeS.
D. BaSO4, FeS2, ZnO.
Lời giải:
Câu 2. Dãy chất nào sau đây phản ứng được với dung dịch HCl
A. CaCO3, ZnO, Zn(OH)2, Zn
B. Cu, CaO, SO2, Al
C. Ag, MgO, NaOH, SO2
D. SO2, Na2O, KOH, NaBr
Lời giải:
Câu 3. Cặp dung dịch nào sau đây phản ứng với nhau tạo ra chất khí?
A. NH4Cl và AgNO3.
B. Zn(OH)2 và NaOH
C. Na2CO3 và HCl.
D. Na2CO3 và KOH.
Lời giải:
Câu 4. Dãy chất nào sau đây, trong nước đều là chất điện li mạnh?
A. H2SO4, Zn(NO3)2, CaCl2, H2S
B. AgCl, CH3COOH, Fe(NO3)3, Zn(OH)2
C. HNO3, Mg(OH)2, BaCl2, NaOH
D. HNO3, CaCl2, AlCl3, Ba(OH)2
Lời giải:
