Hoá học 10 Bài 13: Liên kết cộng hóa trị – HOC247
Chào mừng bạn đến với pgdgiolinhqt.edu.vn trong bài viết về Hoa 10 bai 13 lien ket cong hoa tri la gi lien ket cong hoa tri co cuc va chúng tôi sẽ chia sẻ kinh nghiệm chuyên sâu của mình cung cấp kiến thức chuyên sâu dành cho bạn.
1.1.1. Liên kết cộng hóa trị hình thành giữa các nguyên tử giống nhau. Sự hình thành đơn chất.
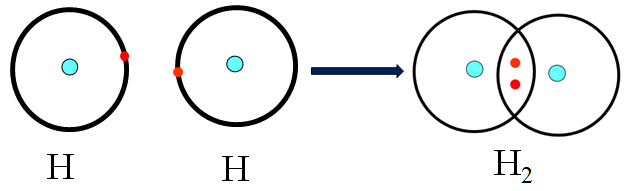
Sự hình thành phân tử H2
- Hai nguyên tử H góp 1 electron tạo thành một cặp electron chung trong phân tử H2.
- Công thức H:H được gọi là công thức electron.
- Công thức H-H gọi là công thức cấu tạo.
Hình 1: Sự hình thành phân tử H2
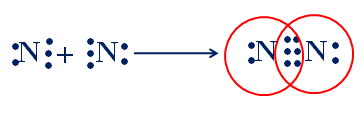
Sự hình thành phân tử nitơ
- Mỗi nguyên tử N góp chung 3e để tạo thành 3 cặp e chung của phân tử N2.
Hình 2: Sự hình thành phân tử N2
-
3 cặp electron liên kết biểu diễn bằng ba gạch ((equiv)), đó là liên kết ba. Liên kết ba bền hơn liên kết đôi và liên kết đơn. Ở nhiệt độ thường N2 kém hoạt động hóa học.
-
CTCT: (N equiv N)
Kết luận
- Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
- Mỗi cặp electron chung tạo nên một liên kết cộng hóa trị.
-
Trong các phân tử H2, N2 tạo nên từ hai nguyên tử của cùng một nguyên tố nên cặp electron chung không bị hút về phía nào. Đó là liên kết cộng hóa trị không cực.
1.1.2. Liên kết giữa các nguyên tử khác nhau. Sự hình thành hợp chất.
Sự hình thành phân tử hyđro clorua (HCl)
- Cấu hình electron của H và Cl là:
(begin{array}{l} {}_1H:1{s^1}\ {}_{17}Cl:1{s^2}2{s^2}2{p^6}3{s^2}3{p^5}; end{array})
- Nhận xét: Nguyên tử H có 1e ở lớp ngoài cùng, còn thiếu 1e để đạt cấu hình electron bền của khí hiếm He. Nguyên tử Cl có 7e ở lớp ngoài cùng, còn thiếu 1e để có vỏ bền kiểu Ar.
-
Mỗi nguyên tử H và Cl góp chung 1e để tạo thành 1 liên kết cộng hóa trị.
Hình 3: Sự hình thành phân tử HCl
- CTCT: H – Cl
-
Giá trị độ âm điện của Cl lớn hơn độ âm điện của H nên cặp e liên kết bị lệch về phía nguyên tử Cl. Liên kết cộng hóa trị này bị phân cực.
- Cặp electron chung bị lệch về phía một nguyên tử được gọi là liên kết cộng hóa trị có cực hay liên kết cộng hóa trị phân cực.
Sự hình thành phân tử khí cacbon đioxit (CO2)
- Cấu hình electron của H và Cl là:
(begin{array}{*{20}{l}} {{}_6C:{rm{ }}1{s^2}2{s^2}2{p^2}}\ {{}_8O:{rm{ }}1{s^2}2{s^2}2{p^4}} end{array})
-
Trong phân tử CO2, nguyên tử C nằm giữa 2 nguyên tử O và nguyên tử C góp chung với mỗi nguyên tử O hai electron.
Hình 4: Sự hình thành phân tử CO2
- Trong phân tử CO2 các cặp electron bị hút lệch về phía O vì oxi có độ âm điện lớn hơn C → Liên kết C=O bị phân cực về phía O
-
Trong phân tử CO2 có cấu tạo thẳng nên liên kết đôi phân cực (C=O) triệt tiêu nhau → Phân tử CO2 không phân cực
1.1.3. Tính chất của các chất có liên kết cộng hóa trị
- Tên các chất mà phân tử chỉ có liên kết cộng hóa trị:
-
Các chất rắn: đường, lưu huỳnh, iot,..
-
Các chất lỏng: nước, rượu, xăng, dầu,…
-
Các chất khí: CO2, Cl2, H2,…
-
-
Tính chất của các chất có liên kết cộng hóa trị:
- Các chất có cực như: etanol, đường,… tan nhiều trong dung môi có cực như nước.
- Phần lớn các chất không cực như: S, I2, các chất hữu cơ không cực tan trong dung môi không cực.
- Kết luận: Các chất có liên kết cộng hóa trị không cực không dẫn điện ở mọi trạng thái.
1.2.1. Quan hệ giữa liên kết cộng hóa trị không cực, liên kết cộng hóa trị có cực và liên kết ion
- Trong phân tử, nếu cặp electron chung ở giữa 2 nguyên tử liên kết ta có liên kết cộng hóa trị không cực.
- Nếu cặp electron chung lệch về một nguyên tử thì đó là liên kết cộng hóa trị có cực.
- Nếu cặp electron chung lệch hẳn về một nguyên tử ta sẽ có liên kết ion.
1.2.2. Hiệu độ âm điện và liên kết hóa học
Hiệu độ âm điện (Delta chi) Loại liên kết (0 le Delta chi < 0,4)
Liên kết cộng hóa trị không cực
(0,4 le Delta chi < 1,7)
Liên kết cộng hóa trị có cực
(Delta chi ge 1,7) Liên kết ion
- Trong NaCl: (Delta chi = {rm{ }}3,16{rm{ }}-{rm{ }}0,93{rm{ }} = {rm{ }}2,23{rm{ }} > {rm{ }}1,7) → liên kết giữa Na và Cl là liên kết ion.
- Trong HCl: (Delta chi = {rm{ }}3,16{rm{ }}-{rm{ }}2,2{rm{ }} = {rm{ }}0,96{rm{ }} to {rm{ }}0,4 le Delta chi le 1,7) → liên kết giữa H và Cl là liên kết cộng hóa trị có cực.
- Trong H2: (Delta chi = {rm{ }}2,2{rm{ }}-{rm{ }}2,2{rm{ }} = {rm{ }}0{rm{ }} to {rm{ }}0 le Delta chi le 0,4)