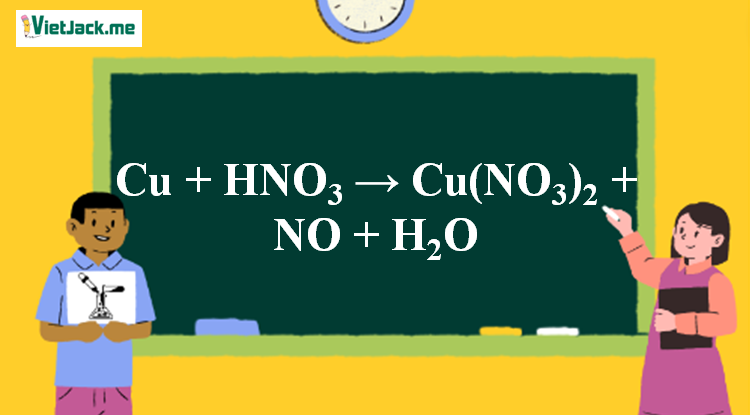
Cu + HNO3 → Cu(NO3)2 + NO+ H2O – VietJack.com
Chào mừng bạn đến với pgdgiolinhqt.edu.vn trong bài viết về Cu hno3 cuno32 no2 h2o chúng tôi sẽ chia sẻ kinh nghiệm chuyên sâu của mình cung cấp kiến thức chuyên sâu dành cho bạn.
Phản ứng Cu + HNO3 → Cu(NO3)2 + NO + H2O
1. Phương trình phản ứng Cu tác dụng HNO3 loãng
2. Cân bằng phương trình phản ứng Cu + HNO3→ Cu(NO3)2 + NO + H2O
Xác định sự thay đổi số oxi hóa
Cuo + HN+5O3→ Cu+2(NO3)2+ N+2O + H2O
Vậy 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Nhắc lại kiến thức: Các bước cân bằng phản ứng bằng phương pháp thăng bằng electron
Bước 1. Viết sơ đồ phản ứng với các chất tham gia xác định nguyên tố có số oxi hóa thay đổi
Bước 2. Viết phương trình:
Khử (Cho electron)
Oxi hóa (nhận electron)
Bước 3. Cân bằng electron: Nhân hệ số để
Tổng số electron cho = tổng số electron nhận
Bước 4. Cân bằng nguyên tố: nói chung theo thứ tự
Kim loại (ion dương)
Gốc axit (ion âm)
Môi trường (axit, bazo)
Nước (cân bằng H2O là để cân bằng hidro)
Bước 5. Kiểm tra số nguyên tử oxi ở hai vế (phải bằng nhau)
3. Điều kiện phản ứng Cu tác dụng với HNO3
Dung dịch HNO3 loãng dư
4. Phương trình ion thu gọn Cu tác dụng HNO3 loãng
6. Cách tiến hành phản ứng cho Cu tác dụng HNO3
Cho đồng Cu tác dụng với dung dịch axit nitric HNO3.
7. Hiện tượng cho Cu tác dụng HNO3 loãng
Kim loại Cu rắn đỏ dần tạo thành dung dịch màu xanh lam và khí không màu hóa nâu trong không khí thoát ra.
8. Tính chất hóa học của HNO3
8.1. Axit nitric thể hiện tính axit
Axit nitric có tính chất của một axit bình thường nên nó làm quỳ tím chuyển sang màu đỏ.
Tác dụng với bazo, oxit bazo, muối cacbonat tạo thành các muối nitrat
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + BaCO3→ Ba(NO3)2 + H2O + CO2
8.2. Tính oxi hóa của HNO3
- Axit nitric tác dụng với kim loại
Tác dụng với hầu hết các kim loại trừ Au và Pt tạo thành muối nitrat và nước .
Kim loại + HNO3 đặc → muối nitrat + NO + H2O ( to)
Mg + HNO3 đặc
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Kim loại + HNO3 loãng lạnh → muối nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
Nhôm, sắt, crom thụ động với axit nitric đặc nguội do lớp oxit kim loại được tạo ra bảo vệ chúng không bị oxy hóa tiếp.
- Axit nitric Tác dụng với phi kim
(Các nguyên tố á kim, ngoại trừ silic và halogen) tạo thành nito dioxit nếu là axit nitric đặc và oxit nito với axit loãng và nước, oxit của phi kim.
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
- Tác dụng với oxit bazo, bazo, muối mà kim loại trong hợp chất này chưa lên hóa trị cao nhất:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3+ NO2 + 2H2O + CO2
3Fe(OH)2 + 10HNO3 → 3Fe(NO3)3 + NO + 8H2O
- Tác dụng với hợp chất
3H2S + 2HNO3 (>5%) → 3S ↓+ 2NO + 4H2O
Ag3PO4 tan trong HNO3, HgS không tác dụng với HNO3.
9. Tính chất hoá học của Cu
Là kim loại kém hoạt động, có tính khử yếu.
9.1. Tác dụng với phi kim
– Cu phản ứng với oxi khi đun nóng tạo CuO bảo vệ nên Cu không bị oxi hoá tiếp tục.
– Khi tiếp tục đun nóng tới (800-1000oC)
– Tác dụng với Cl2, Br2, S…
9.2. Tác dụng với axit
– Cu không tác dụng với dung dịch HCl, H2SO4 loãng.
– Khi có mặt oxi, Cu tác dụng với dung dịch HCl, nơi tiếp xúc giữa dung dịch axit với không khí.
2Cu + 4HCl + O2 → 2CuCl2 + 2 H2O
– Với HNO3, H2SO4 đặc :
Cu + 2H2SO4 đ → CuSO4 + SO2 + H2O
Cu + 4HNO3 đ → Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2O
9.3. Tác dụng với dung dịch muối
Khử được ion kim loại đứng sau nó trong dung dịch muối.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
10. Bài tập vận dụng liên quan
Câu 1. Ứng dụng nàosau đây không phải của HNO3?
A. Để điều chế phân đạm NH4NO3, Ca(NO3)2
B. Sản xuất dược phẩm
C. Sản xuất khí NO2 và N2H4
D. Để sản xuất thuốc nổ, thuốc nhuộm
Lời giải:
Câu 2. Phát biểu nào sau đây đúng:
A. Dung dịch HNO3 làm xanh quỳ tím và làm phenolphtalein hóa đỏ.
B. Axit nitric được dùng để sản xuất phân đạm (NH4NO3, Ca(NO3)2), thuốc nổ (TNT), thuốc nhuộm, dược phẩm.
C. Trong công nghiệp, để sản xuất HNO3 người ta đun hỗn hợp (KNO3) với H2SO4 đặc
D. điều chế HNO3 trong phòng thí nghiệm người ta dùng khí amoniac (NH3)
Lời giải:
Câu 3. Trong các thí nghiệm với dung dịch HNO3 thường sinh ra khí độc NO2. Để hạn chế khí NO2 thoát ra từ ống nghiệm, người ta sử dụng biện pháp nhét bông có tẩm hóa chất và nút ống nghiệm. Hóa chất đó chính là
A. H2O
B. Dung dịch nước vôi trong
C. dung dịch giấm ăn
D. dung dịch muối ăn
Lời giải:
Câu 4. Chất nào sau đây không tạo kết tủa khi cho vào dung dịch AgNO3:
A. HCl
B. HNO3
C. KBr
D. K3PO4
Lời giải:
Câu 5. Cho 19,2 gam Cu tan hoàn toàn trong dung dịch HNO3 loãng dư, sau phản ứng thu được V lít NO (đktc, sản phẩm khử duy nhất). Giá trị của V là:
A. 6,72 lít
B. 2,24 lít
C. 3,36 lít
D. 4,48 lít
Lời giải:
Câu 6. Cho phương trình hóa học sau: Fe + HNO3 → Fe(NO3)3 + NO + H2O
Tổng hệ số tối giản của phương trình sau:
A. 8
B. 9
C. 12
D. 16
Lời giải:
Câu 7. Cho Cu (z = 29), vị trí của Cu trong bảng tuần hoàn là
A. ô 29, chu kỳ 4, nhóm IB.
B. ô 29, chu kỳ 4, nhóm IA.
C. ô 29, chu kỳ 4, nhóm VIIIB.
D. ô 29, chu kỳ 4, nhóm IIB.
Lời giải:
Câu 8. Chỉ dùng 1 chất để phân biệt 3 kim loại sau: Al, Ba, Mg?
A. Dung dịch HCl
B. Nước
C. Dung dịch NaOH
D. Dung dịch H2SO4
Lời giải:
Câu 9. Cho các dung dịch: HCl, NaOH đặc, NH3, KCl. Số dung dịch phản ứng được với Cu(OH)2 là
A. 1.
B. 3.
C. 2.
D. 4.
Lời giải:
Câu 10. Hiện tượng nào xảy ra khi cho mảnh đồng kim loại vào dung dịch HNO3 loãng
A. không có hiện tượng gì
B. dung dịch có màu xanh, H2 bay ra
C. dung dịch có màu xanh, có khí màu nâu bay ra
D. dung dịch có màu xanh lam, có khí không màu bay ra, bị hoá nâu trong không khí.
Lời giải:
Câu 11. Hòa tan m gam Al vào dung dịch HNO3 loãng vừa đủ, thu được 17,92 lít (đktc) hỗn hợp khí X gồm N2O và N2 biết tỉ khối hơi của X so với H2 là 18 (không còn sản phẩm khử nào khác) và dd Y chứa a gam muối nitrat. Giá trị của m là.
A. 21,6
B. 97,2
C. 64,8
D. 194,4
Lời giải:
Câu 12. Nhận định đúng về phản ứng điều chế HNO3 trong phòng thí nghiệm bằng phản ứng
NaNO3 + H2SO4 → HNO3+ NaHSO4.
A. có thể dùng axit sunfuric loãng.
B. có thể thay thế natri nitrat bằng kali nitrat.
C. axit nitric thu được ở dạng lỏng không cần làm lạnh.
D. đây là phản ứng oxi hóa khử
Lời giải:
Câu 13. Cho các mô tả sau:
(1). Hoà tan Cu bằng dung dịch HCl đặc nóng giải phóng khí H2
(2). Ðồng dẫn nhiệt và dẫn điện tốt, chỉ thua Ag
(3). Ðồng kim loại có thể tan trong dung dịch FeCl3
(4). Có thể hoà tan Cu trong dung dịch HCl khi có mặt O2
(5). Ðồng thuộc nhóm kim loại nhẹ (d = 8,98 g/cm3)
(6). Không tồn tại Cu2O; Cu2S
Số mô tả đúng là:
A. 1.
B. 2.
C. 3 .
D. 4.
Lời giải:
Câu 14. Nung 6,58 gam Cu(NO3)2 trong bình kín không chứa không khí, sau một thời gian thu được 4,96 gam chất rắn và hỗn hợp khí X. Hấp thụ hoàn toàn X vào nước để được 300 ml dung dịch Y. Dung dịch Y có pH bằng
A. 2.
B. 3.
C. 4.
D. 1.
Lời giải:
Câu 15. Nhúng một thanh sắt nặng 100 gam vào 100 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và AgNO3 0,2M. Sau một thời gian lấy thanh kim loại ra, rửa sạch làm khô cân được 101,72 gam (giả thiết các kim loại tạo thành đều bám hết vào thanh sắt). Khối lượng sắt đã phản ứng là
A. 2,16 gam.
B. 0,84 gam.
C. 1,72 gam.
D. 1,40 gam.
Lời giải:
Câu 16. Cho Cu và dung dịch H2SO4 loãng tác dụng với chất X (một loại phân bón hóa học), thấy thoát ra khí không màu hóa nâu trong không khí. Mặt khác, khi X tác dụng với dung dịch NaOH thì có khí mùi khai thoát ra. Chất X là
A. amophot.
B. ure.
C. natri nitrat.
D. amoni nitrat.
Lời giải:
Câu 17. Nhúng một thanh Cu vào dung dịch AgNO3, sau một thời gian lấy ra, rửa sạch, sấy khô, đem cân thì khối lượng thanh đồng thay đổi thế nào?
A. Tăng.
B. Giảm.
C. Không thay đổi.
D. không xác định được.
Lời giải:
Câu 18. Hoà tan hoàn toàn 12 gam hỗn hợp Fe và Cu (tỉ lệ mol 1:1) bằng axit HNO3, thu được V lít (đktc) hỗn hợp khí X (gồm NO và NO2) và dung dịch Y (chỉ chứa hai muối và axit dư). Tỉ khối của X đối với H2 bằng 19. Giá trị của V là:
A. 2,24
B. 5,60
C. 3,36
D. 4,48
Lời giải:
Câu 19. Nung 8,4 gam Fe trong không khí, sau phản ứng thu được m gam chất rắn X gồm Fe, Fe2O3, Fe3O4, FeO. Hòa tan m gam hỗn hợp X vào dung dich HNO3 dư thu được 2,24 lít khí NO2 (đktc) là sản phẩm khử duy nhất. Giá trị của m là:
A. 11,2 gam
B. 10,2 gam
C. 7,2 gam
D. 6,9 gam
Lời giải:
Câu 20. Để nhận biết ion người ta thường dùng Cu và dung dịch HNO3 loãng và đun nóng, vì:
A. Phản ứng tạo ra dung dịch có màu vàng nâu
B. Phản ứng tạo ra dung dịch có màu xanh và khí không mùi làm xanh giấy quỳ ẩm
C. Phản ứng tạo ra kết tủa màu xanh
D. Phản ứng tạo dung dịch có màu xanh và khí không màu hoá nâu trong không khí.
Lời giải:
Câu 21. Thể tích dung dịch HNO3 1M (loãng) ít nhất cần dùng để hoà tan hoàn toàn một hỗn hợp gồm 0,3 mol Fe và 0,3 mol Cu là (biết phản ứng tạo chất khử duy nhất là NO)
A. 1,0 lít
B. 1,6 lít
C. 0,8 lít
D. 1,2 lít
Lời giải:
Câu 22. Phương trình điều chế HNO3 trong phòng thí nghiệm
A. 4NO2 + 2H2O + O2 → 4HNO3
B. N2O5 + H2O → 2HNO3
C. 2Cu(NO3)2 + 2H2O →2Cu + 4HNO3 + O2
D. NaNO3 (r) + H2SO4 đặc → HNO3 + NaHSO4
Lời giải:
Câu 23. Kết luận nào sau đây không đúng khi nói về H2SO4?
A. H2SO4 loãng có đầy đủ tính chất chung của axit
B. Khi tiếp xúc với H2SO4 đặc dễ gây bỏng nặng
C. Khi pha loãng axit sunfuric, chỉ được cho từ từ nước vào axit
D. H2SO4 đặc là chất hút nước mạnh
Lời giải:
Câu 24. Sự khác biệt nhất trong tính chất hóa học của H2SO4 đặc so với H2SO4 loãng là
A. Tác dụng được với oxit bazơ
B. Tác dụng được với bazơ
C.Tác dụng được với muối
D. Khả năng hút nước mạnh (tính háo nước)
Lời giải:
Câu 25. Chất nào dùng làm thuốc thử để phân biệt hai dung dịch axit clohidric và axit sunfuric?
A. AlCl3.
B. BaCl2.
C. NaCl.
D. MgCl2
Lời giải:
