Ba(OH)2 + H2SO4 → BaSO4 + H2O – VietJack.com
Chào mừng bạn đến với pgdgiolinhqt.edu.vn trong bài viết về Baoh2 h2so4 chúng tôi sẽ chia sẻ kinh nghiệm chuyên sâu của mình cung cấp kiến thức chuyên sâu dành cho bạn.
Phản ứng Ba(OH)2 + H2SO4 → BaSO4 + H2O
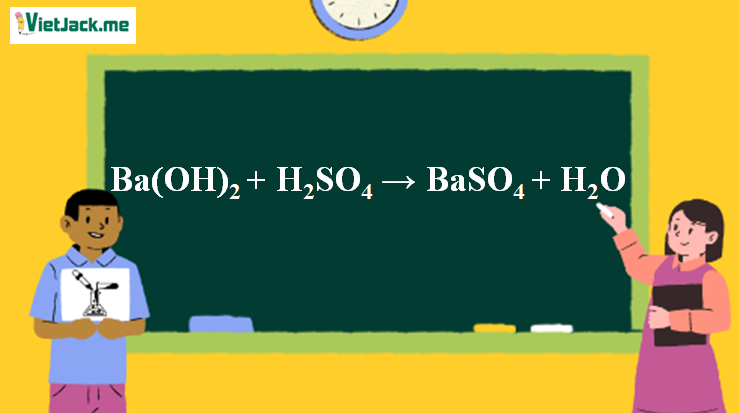
1. Phương trình phản ứng Ba(OH)2 tác dụng H2SO4
Ba(OH)2 + H2SO4 → BaSO4+ 2H2O
2. Điều kiện phản ứng H2SO4 ra BaSO4
Nhiệt độ thường
3. Hiện tượng phản ứng Ba(OH)2 tác dụng H2SO4
Nhỏ dung dịch Ba(OH)2 vào axit H2SO4 thì có hiện tượng kết tủa trắng.
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của Ba(OH)2 (Bari hidroxit)
Ba(OH)2 mang đầy đủ tính chất của một bazo mạnh phản ứng được với các axit như HCl, H2SO4, …
4.2. Bản chất của H2SO4 (Axit sunfuric)
H2SO4 là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit tác dụng với bazo tạo thành muối mới và nước.
5. Tính chất hoá học của H2SO4
5.1. H2SO4 loãng
Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước .
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric tác dụng với bazo tạo thành muối mới và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
5.2. H2SO4 đặc
Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
- Tác dụng với kim loại: Khi cho mảnh Cu vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí bay ra với mùi sốc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim tạo thành oxit phi kim + H2O + SO2.
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng như đưa H2SO4 vào cốc đựng đường, sau phản ứng đường sẽ bị chuyển sang màu đen và phun trào với phương trình hóa học như sau.
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
6. Tính chất hóa học của Ba(OH)2
Mang đầy đủ tính chất hóa học của một bazơ mạnh.
Phản ứng với các axit:
Ba(OH)2 + 2HCl → BaCl2+ 2H2O
Phản ứng với oxit axit: SO2, CO2…
Ba(OH)2 + SO2 → BaSO3 + H2O
Ba(OH)2 + 2SO2 → Ba(HSO3)2
Phản ứng với các axit hữu cơ tạo thành muối:
2CH3COOH + Ba(OH)2 → (CH3COO)2Ba + 2H2O
Phản ứng thủy phân este:
2CH3COOC2H5 + Ba(OH)2 → (CH3COO)2Ba + 2 C2H5OH
Phản ứng với muối:
Ba(OH)2 + CuCl2 → BaCl2 + Cu(OH)2↓
Tác dụng một số kim loại mà oxit, hidroxit của chúng có tính lưỡng tính (Al, Zn…):
Ba(OH)2 + 2Al + 2H2O → Ba(AlO2)2 + 3H2↑
Tác dụng với hợp chất lưỡng tính:
Ba(OH)2 + 2Al(OH)3 → Ba(AlO2)2 + 4H2O
Ba(OH)2 + Al2O3 → Ba(AlO2)2 + H2
7. Bài tập vận dụng
Câu 1. Nhỏ dung dịch Ba(OH)2 vào axit H2SO4 thì thấy hiện tượng gì:
A. Có khí không màu bay ra
B. Có kết tủa trắng
C. Không có hiện tượng gì
D. Có kết tủa trắng xanh
Lời giải:
Đáp án: B
Giải thích:
Nếu nhỏ dung dịch Ba(OH)2 vào axit H2SO4 thì có hiện tượng kết tủa trắng
Câu 2. Để nhận biết 2 dung dịch axit trong suốt HCl, H2SO4người ta sử dụng hóa chất nào sau đây
A. Dung dịch nước vôi trong
B. Quỳ tím
C. Dung dịch muối bari clorua
D. Dung dịch muối nitrat
Lời giải:
Đáp án: C
Câu 3. Cho các phản ứng sau
1) BaCl2 + H2SO4;
(2) Ba(OH)2+ Na2SO4;
(3) BaCl2 + (NH4)2SO4
(4) Ba(OH)2 + (NH4)2SO4;
(5) Ba(OH)2 + H2SO4;
Các phản ứng có phương trình ion rút gọn: Ba2+ + SO42-→ BaSO4 là:
A. (1), (2), (3)
B. (1), (2), (5)
C. (2), (3), (4)
D. (1), (2), (4)
Lời giải:
Đáp án: A
Giải thích:
(1) BaCl2 + H2SO4 → BaSO4 + 2HCl
phương trình ion rút gọn: Ba2+ + SO42- → BaSO4
(2) Ba(OH)2+ Na2SO4 → BaSO4 + 2NaOH
phương trình ion rút gọn: Ba2+ + SO42-→ BaSO4
(3) BaCl2 + (NH4)2SO4→ 2NH4Cl + BaSO4
phương trình ion rút gọn: Ba2+ + SO42- → BaSO4
(4) Ba(OH)2 + (NH4)2SO4→ BaSO4 + 2NH3 + 2H2O
(5) Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
Câu 4. Trung hòa vừa đủ 250ml dung dịch Ba(OH)2 1M với dung dịch H2SO4 15%. Khối lượng dung dịch H2SO4 đã dùng là:
A. 163,3 gam
B. 326,6 gam
C. 217,7 gam
D. 312,6 gam
Lời giải:
Đáp án: A
Giải thích:
nBa(OH)2 = 0,25 mol
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
0,25 0,25 mol
Khối lượng H2SO4 đã dùng là:
mddH2SO4 = (0,25.98).100%/15% = 163,3 gam
Câu 5. Cho dung dịch chứa các ion sau: Na+, Ca2+, Mg2+, Ba2+, H+, NO3-. Muốn tách được nhiều cation ra khỏi dung dịch mà không đưa ion lạ vào dung dịch người ta dùng:
A. Dung dịch K2CO3 vừa đủ .
B. Dung dịch Na2SO4 vừa đủ.
C. Dung dịch KOH vừa đủ.
D. Dung dịch Na2SO3 vừa đủ.
Lời giải:
Đáp án: D
Xem thêm các phương trình phản ứng hóa học khác:
K + H2O → KOH + H2
K2O + H2O → KOH
KCl + H2O → KOH + H2 + Cl2
K2CO3 + HCl → KCl + CO2 + H2O
KClO3 + HCl → Cl2 + KCl + H2O
