FeSO4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + Cr2 … – VietJack.com
Chào mừng bạn đến với pgdgiolinhqt.edu.vn trong bài viết về Feso4 k2cr2o7 h2so4 fe2so43 cr2so43 k2so4 h2o chúng tôi sẽ chia sẻ kinh nghiệm chuyên sâu của mình cung cấp kiến thức chuyên sâu dành cho bạn.
Phản ứng FeSO4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
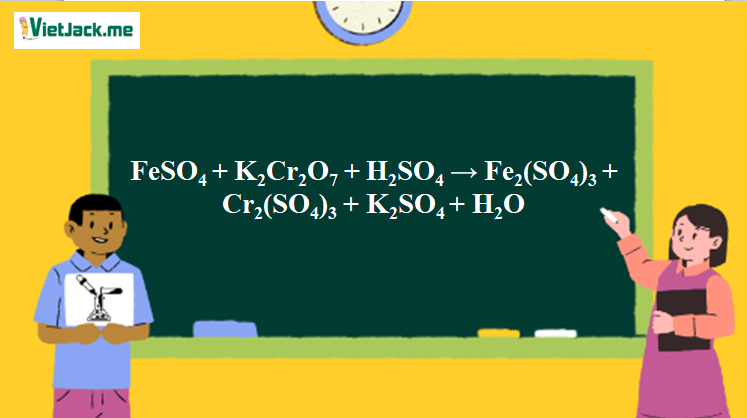
1. Cân bằng phản ứng oxi hóa – khử sau K2Cr2O7 + FeSO4 + H2SO4
2. Điều kiện phản ứng K2Cr2O7 + FeSO4 + H2SO4
Không có
3. Cân bằng phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron
FeSO4 + K2Cr2O7+ H2SO4 → Fe2(SO4)3+ K2SO4 + Cr2(SO4)2+ H2O.
Hướng dẫn cân bằng phương trình oxi hóa khử
Fe+2SO4 + K2Cr+62O7 + H2SO4→ Fe2+3(SO4)3 + K2SO4 + Cr2+3(SO4)2 + H2O.
Quá trình oxi hóa: 6x
Quá trình khử: 1x
Fe2+ → Fe3+ + 1e
2Cr6+ + 2.3e → 2Cr+3
Hay 6FeSO4 + K2Cr2O7→ 3Fe2(SO4)3 + Cr2(SO4)3
Kiểm tra hai vế: thêm K2SO4 vào về phải; thêm 7H2SO4 vào vế trái → thêm 7H2O vào vế phải.
⇒ 6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3+ K2SO4 + Cr2(SO4)2 + 7H2O
4. Kiến thức về FeSO4
4.1. Tính chất vật lí và nhận biết
– Tính chất vật lý: Có khả năng hút ẩm tốt, thường tồn tại ở trạng thái ngậm nước. Tan tốt trong nước cho dung dịch không màu.
– Nhận biết: Sử dụng dung dịch BaCl2, thấy xuất hiện kết tủa trắng:
FeSO4 + BaCl2 → BaSO4 + FeCl2.
4.2. Tính chất hóa học
– Mang đầy đủ tính chất hóa học của muối.
– Có tính khử và tính oxi hóa:
Tính khử: Fe2+ → Fe3+ + 1e
Tính oxi hóa: Fe2+ + 1e → Fe
a. Tính chất hóa học của muối:
– Tác dụng với dung dịch kiềm:
FeSO4 + KOH → K2SO4 + Fe(OH)2
– Tác dụng với muối:
FeSO4 + BaCl2 → BaSO4 + FeCl2.
b. Tính khử:
FeSO4 + Cl2 → FeCl3 +Fe2(SO4)3
2FeSO4 + 2H2SO4 đặc nóng → Fe2(SO4)3 + SO2 + 2H2O
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
c. Tính oxi hóa:
FeSO4 + Mg → MgSO4 + Fe
4.3. Điều chế
Cho kim loại Fe dư tác dụng với axit HNO3
3Fe + 8HNO3 → 4H2O + 2NO + 3Fe(NO3)2
5. Tính chất hoá học của K2Cr2O7
– Dung dịch của K2Cr2O7 sẽ làm quỳ tím hóa đỏ.
– Chúng là một chất oxy hóa mạnh, trong môi trường axit muối Cr(VI) bị khử thành muối Cr(III):
K2Cr2O7 + 6FeSO4 + 7H2SO4 → 3Fe2(SO4)3 +Cr2(SO4)3 + K2SO4 + 7H2O
– Chúng có thể tác dụng với dung dịch bazơ để sinh ra muối có màu vàng là K2CrO4:
K2Cr2O7 + KOH → K2CrO4 + H2O
– Ở nhiệt độ 500 độ C, nó bị phân hủy thành muối cromat:
4K2Cr2O7 → 4K2CrO4 + 2Cr2O3 + H2O
– Tác dụng được với các axit như HCl hoặc H2SO4 như sau:
K2Cr2O7 + H2SO4 → 2K2Cr3O10 + K2SO4 + H2O
K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2 + 7H2O
6. Câu hỏi vận dụng liên quan
Câu 1. Phương trình phản ứng oxi hoá – khử là phương trình nào dưới đây?
A. Fe + 3AgNO3 → Fe(NO3)3 + 3Ag
B. Ca(HCO3)2→ CaCO3 + CO2 + H2
C. BaCl2 + K2SO4→ BaSO4 + 2KCl
D. CaO + CO2 → CaCO3
Lời giải:
Câu 2. Phương trình phản ứng oxi hoá – khử là phương trình nào dưới đây?
A. NaOH + HCl → NaCl + H2O
B. AgNO3 + KBr → AgBr + KNO3
C. BaCl2 + Na2SO4 → BaSO4 + 2NaCl
D. Na + H2O → NaOH + 12H2
Lời giải:
Câu 3. Cho các phản ứng sau:
(a) 4HCl + MnO2→ MnCl2 + Cl2 + 2H2O.
(b) HCl + NH4HCO3→ NH4Cl + CO2 + H2O.
(c) 2HCl + 2HNO3→ 2NO2 + Cl2 + 2H2O.
(d) 2HCl + Zn → ZnCl2 + H2.
Số phản ứng trong đó HCl thể hiện tính khử là
A. 1
B. 2
C. 3
D. 4
Lời giải:
Câu 4. Trong các phản ứng: FeO + 4HNO3 → Fe(NO3)3+ NO2 + 2H2O. Chất khử là
A. Fe(NO3)3
B. NO2
C. FeO
D. HNO3
Lời giải:
Câu 5. Cho sơ đồ phản ứng: FeSO4 + K2Cr2O7+ H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O. Hệ số cân bằng của FeSO4 là
A. 10
B. 6
C. 8
D. 4
Lời giải:
Câu 6. Cho amoniac NH3 tác dụng với oxi ở nhiệt độ cao có xúc tác thích hợp sinh ra nitơ oxit NO và nước. Phương trình hoá học: 4NH3+ 5O2 → 4NO + 6H2O. Trong phản ứng trên, NH3 đóng vai trò
A. là chất oxi hoá.
B. là chất khử.
C. là một bazơ.
D. là một axit.
Lời giải:
