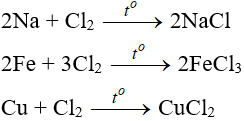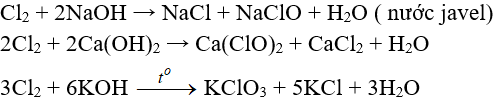FeCl2 + Cl2 → FeCl3 | FeCl2 ra FeCl3 – Tailieumoi.vn
Chào mừng bạn đến với pgdgiolinhqt.edu.vn trong bài viết về Fecl2 ra fecl3 chúng tôi sẽ chia sẻ kinh nghiệm chuyên sâu của mình cung cấp kiến thức chuyên sâu dành cho bạn.
Tailieumoi.vn xin giới thiệu phương trình FeCl2 + Cl2 → FeCl3 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình FeCl2 + Cl2 → FeCl3
1. Phương trình phản ứng hóa học
2FeCl2 + Cl2 → 2FeCl3
2. Hiện tượng nhận biết phản ứng.
– Khí màu vàng clo (Cl2) tan dần trong dung dịch Sắt II clorua (FeCl2) màu xanh lam nhạt và chuyển thành màu nâu đỏ của dung dịch Sắt III clorua (FeCl3).
3. Điều kiện phản ứng
– Nhiệt độ thường
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của FeCl2 (Sắt (II) clorua)
– Trong phản ứng trên FeCl2 là chất khử.
– FeCl2 thể hiện tính khử khá mạnh khi tác dụng với các chất oxi hoá mạnh như clo.
4.2. Bản chất của Cl2 (Clo)
– Trong phản ứng trên Cl2 là chất oxi hoá.
– Cl2 có khả năng tác dụng với các muối halogen khác.
5. Tính chất hóa học
5.1. Tính chất hóa học của FeCl2
Sắt(II) clorua là tên gọi để chỉ một hợp chất được tạo bởi sắt và 2 nguyên ử clo. Thường thu được ở dạng chất rắn khan. Công thức phân tử: FeCl2
5.1.1. Tính chất vật lí và nhận biết
Tính chất vật lý: Nó là một chất rắn thuận từ có nhiệt độ nóng chảy cao, và thường thu được dưới dạng chất rắn màu trắng. Tinh thể dạng khan có màu trắng hoặc xám; dạng ngậm nước FeCl2.4H2O có màu xanh nhạt.
Trong không khí, dễ bị chảy rữa và bị oxi hoá thành sắt (III).
Nhận biết: Sử dụng dung dịch AgNO3, thấy xuất hiện kết tủa trắng.
FeCl2+ 2AgNO3 → Fe(NO3)2 + 2AgCl↓
5.1.2. Tính chất hóa học của sắt (II)
Mang đầy đủ tính chất hóa học của muối.
Có tính khử Fe2+ → Fe3+ + 1e
Tác dụng với dung dịch kiềm:
FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
Tác dụng với muối
FeCl2 + 2AgNO3 → Fe(NO3)2 + 2AgCl
- Tính khử:
Thể hiện tính khử khi tác dụng với các chất oxi hóa mạnh:
2FeCl2 + Cl2 → 2FeCl3
5.1.3. Điều chế FeCl2
- Cho kim loại Fe tác dụng với axit HCl:
Fe + 2HCl → FeCl2+ H2
- Cho sắt (II) oxit tác dụng với HCl
FeO + 2HCl → FeCl2 + H2O
5.2. Tính chất hóa học của Cl2
a. Tác dụng với kim loại
Đa số kim loại và có to để khơi màu phản ứng tạo muối clorua (có hoá trị cao nhất )
b. Tác dụng với phim kim
(cần có nhiệt độ hoặc có ánh sáng)
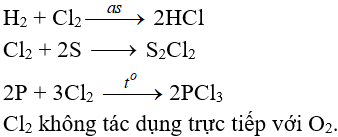
c. Tác dụng với nước và dung dịch kiềm
Cl2 tham gia phản ứng với vai trò vừa là chất ôxi hóa, vừa là chất khử.
c.1. Tác dụng với nuớc
Khi hoà tan vào nước, một phần Clo tác dụng (Thuận nghịch)
Cl20 + H2O → HCl + HClO (Axit hipoclorơ)
Axit hipoclorơ có tính oxy hoá mạnh, nó phá hửy các màu vì thế nước clo hay clo ẩm có tính tẩy màu do.
c.2. Tác dụng với dung dịch bazơ
d. Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
Cl2 + 2KI → 2KCl + I2
e. Tác dụng với chất khử khác
f. Phản ứng thế, phản ứng cộng, phản ứng phân huỷ với một số hợp chất hữu cơ
6. Cách thực hiện phản ứng
– Muối Sắt II FeCl2 bị oxi hóa bởi Cl2
7. Bạn có biết
– Hiện tại chúng tôi không có thêm bất kỳ thông tin nào thêm về phương trình này.
8. Bài tập liên quan
9. Một số phương trình phản ứng hoá học khác của Sắt (Fe) và hợp chất:
FeCl2 + Cl2 → FeCl3