Fe3O4 + HCl → FeCl3 + FeCl2 + H2O – VietJack.com
Chào mừng bạn đến với pgdgiolinhqt.edu.vn trong bài viết về Fe3o4 hcl fecl3 fecl2 h2o chúng tôi sẽ chia sẻ kinh nghiệm chuyên sâu của mình cung cấp kiến thức chuyên sâu dành cho bạn.
Phản ứng Fe3O4 + HCl → FeCl3 + FeCl2 + H2O
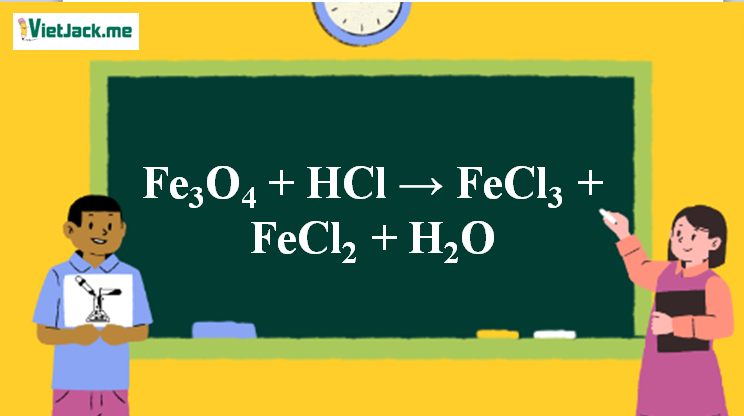
1. Phương trình phản ứng Fe3O4 ra FeCl3
2. Điều kiện phản ứng Fe3O4 tác dụng với dung dịch axit HCl
Nhiệt độ
3. Cách thực hiện phản ứng Fe3O4 tác dụng với dung dịch axit HCl
Cho Fe3O4 vào ống nghiệm, nhỏ 1-2ml dung dịch axit HCl vào ống nghiệm đã bỏ sẵn Fe3O4 rồi đun trên ngọn lửa đèn cồn.
4. Hiện tượng sau phản ứng Fe3O4 tác dụng HCl
Sau phản ứng sinh ra hỗn muối.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của Fe3O4 (Sắt từ oxit)
Fe3O4 tác dụng với dung dịch axit như HCl, H2SO4 loãng tạo ra hỗn hợp muối sắt (II) và sắt (III).
5.2. Bản chất của HCl (Axit clohidric)
HCl tác dụng oxit kim loại tạo thành muối clorua + nước.
6. Tính chất của Fe3O4
Định nghĩa: Là hỗn hợp của hai oxit FeO, Fe2O3. Có nhiều trong quặng manhetit, có từ tính.
Công thức phân tử Fe3O4
6.1. Tính chất vật lí
Là chất rắn, màu đen, không tan trong nước và có từ tính.
6.2. Tính chất hóa học
- Tính oxit bazơ
Fe3O4 tác dụng với dung dịch axit như HCl, H2SO4 loãng tạo ra hỗn hợp muối sắt (II) và sắt (III).
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
Fe3O4 + 4H2SO4 loãng→ Fe2(SO4)3 + FeSO4 + 4H2O
- Tính khử
Fe3O4 là chất khử khi tác dụng với các chất có tính oxi hóa mạnh:
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
2Fe3O4 + 10H2SO4 → 3Fe2(SO4)3 + SO2↑ + 10H2O
- Tính oxi hóa
Fe3O4 là chất oxi hóa khi tác dụng với các chất khử mạnh ở nhiệt độ cao như: H2, CO, Al:
Fe3O4 + 4H2 → 3Fe + 4H2O
Fe3O4 + 4CO → 3Fe + 4CO2
3Fe3O4 + 8Al → 4Al2O3 + 9Fe
8. Tính chất hoá học của HCl
Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
8.1. Tác dụng chất chỉ thị
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl-
8.2. Tác dụng với kim loại
Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Fe + 2HCl FeCl2 + H2
2Al + 6HCl 2AlCl3 + 3H2
Cu + HCl → không có phản ứng
8.3. Tác dụng với oxit bazo và bazo
Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl CuCl2 + H2 O
Fe2 O3 + 6HCl 2FeCl3 + 3H2 O
8.4. Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng để nhận biết gốc clorua )
Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2 MnCl2 + Cl + 2H2 O
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan ( cường thuỷ) có khả năng hoà tan được Au ( vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
9. Bài tập vận dụng liên quan
Câu 1. Phản ứng xảy ra khi đốt cháy sắt trong không khí là
A. 3Fe + 2O2 → Fe3O4.
B. 4Fe + 3O2 → 2Fe2O3.
C. 2Fe + O2 → 2FeO.
D. tạo hỗn hợp FeO, Fe2O3, Fe3O4.
Lời giải:
Câu 2. Dãy các phi kim nào sau đây khi lấy dư tác dụng với Fe thì chỉ oxi hoá Fe thành Fe (III)?
A. Cl2, O2, S
B. Cl2, Br2, I2
C. Br2, Cl2, F2
D. O2, Cl2, Br2
Lời giải:
Câu 3. Nhận xét nào sau đây không đúng
A. Trong dung dịch Fe khử được ion Cu2+ thành Cu.
B. Bột nhôm bốc cháy khi gặp khí clo.
C. Các kim loại Na, K, Ba đều phản ứng với nước ở điều kiện thường.
D. Fe phản ứng với dung dịch HCl hay phản ứng với Clo đều tạo thành một loại muối.
Lời giải:
Câu 4. Kim loại X phản ứng với dung dịch FeCl3, không phản ứng được với dung dịch HCl. Vậy kim loại X là
A. Mg
B. Fe
C. Cu
D. Ag
Lời giải:
Câu 5. Cho Zn dư vào dung dịch AgNO3, Cu(NO3)2, Fe(NO3)3. Số phản ứng hoá học xảy ra là:
A. 1.
B. 2.
C. 3.
D. 4
Lời giải:
Câu 6. Hòa tan Fe3O4 vào dung dịch HCl dư, thu được dung dịch X. Cho dãy các chất: KMnO4; Cl2; KOH; Na2CO3; CuSO4, HNO3; Fe; NaNO3. Số chất trong dãy tác dụng được với dung dịch X là
A. 7
B. 5
C. 4
D. 6
Lời giải:
Câu 7. Cho 23,2 gam Fe3O4 tác dụng với dung dịch HCl dư thu được muối sắt có khối lượng là:
A. 48,6 gam
B. 28,9 gam
C. 45,2 gam
D. 25,4 gam
Lời giải:
Câu 8. Cho 2,24 gam Fe tác dụng với oxi, thu được 3,04 gam hỗn hợp X gồm 2 oxit. Để hoà tan hết X cần thể tích dung dịch HCl 2M là
A. 25 ml.
B. 50 ml.
C. 100 ml.
D. 150 ml.
Lời giải:
Câu 9. Để điều chế Fe(NO3)2 ta có thể dùng phản ứng nào sau đây?
A. Fe + dung dịch AgNO3 dư
B. Fe + dung dịch Cu(NO3)2
C. FeO + dung dịch HNO3
D. FeS + dung dịch HNO3
Lời giải:
Câu 10. Dãy các chất và dung dịch nào sau đây khi lấy dư có thể oxi hoá Fe thành Fe (III)?
A. HCl, HNO3 đặc, nóng, H2SO4 đặc, nóng
B. Cl2, HNO3 nóng, H2SO4 đặc, nguội
C. bột lưu huỳnh, H2SO4 đặc, nóng, HCl
D. Cl2, Cu(NO3)2, HNO3 loãng
Lời giải:
Câu 11. Hòa tan hoàn toàn 5,6 gam hỗn hợp FeO, Fe2O3 và Fe3O4 cần vừa đủ V ml dung dịch HCl 1M , thu được dung dịch X. Cho từ từ dung dịch NaOH dư vào dung dịch X thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi thu được 6 gam chất rắn. Tính V ?
A. 87,5ml
B. 125ml
C. 62,5ml
D. 175 ml
Lời giải:
Câu 12. Dung dịch X gồm 0,2 mol HCl và 0,025 mol Cu(NO3)2. Cho m gam bột Fe vào dung dịch, khuấy đều cho đến khi phản ứng kết thúc thu được chất rắn Z gồm hai kim loại có khối lượng 0,4m gam. Giả sử sản phẩm khử HNO3 duy nhất chỉ có NO. Giá trị của m bằng:
A. 20 gam
B. 30 gam
C. 40 gam
D. 50 gam
Lời giải:
Câu 13. Thổi hỗn hợp khí CO và H2 đi qua a gam hỗn hợp gồm CuO và Fe3O4 có tỉ lệ mol 1:2, sau phản ứng thu được b gam chất rắn X. Hòa tan hoàn toàn b gam X bằng dung dịch HNO3 loãng dư, thu được dung dịch Y (không chứa ion Fe2+). Cô cạn dung dịch Y thu được 82 gam muối khan. Giá trị của a là
A. 27,2.
B. 10,6.
C. 12,8.
D. 13,6.
Lời giải:
Câu 14. Những nhận định sau về kim loại sắt:
(1) Kim loại sắt có tính khử trung bình.
(2) Ion Fe2+ bền hơn Fe3+.
(3) Fe bị thụ động trong H2SO4 đặc nguội.
(4) Quặng manhetit là quặng có hàm lượng sắt cao nhất.
(5) Trái đất tự quay và sắt là nguyên nhân làm Trái Đất có từ tính.
(6) Kim loại sắt có thể khử được ion Fe3+.
Số nhận định đúng là
A. 3
B. 4
C. 5
D. 6
Lời giải:
Câu 15. Ngâm thanh Cu (dư) vào dung dịch AgNO3 thu được dung dịch X. Sau đó ngâm thanh Fe (dư) vào dung dịch X thu được dung dịch Y. Biết các phản ứng xảy ra hoàn toàn. Dung dịch Y có chứa chất tan là:
A. Fe(NO3)3.
B. Fe(NO3)2.
C. Fe(NO3)2, Cu(NO3)2
D. Fe(NO3)3, Fe(NO3)2.
Lời giải:
Câu 16. Có 4 dung dịch đựng riêng biệt: (a) HCl; (b) CuCl2; (c) FeCl2; (d) HCl có lẫn CuCl2. Nhúng vào mỗi dung dịch một thanh sắt nguyên chất. Số trường hợp xảy ra ăn mòn điện hóa là
A. 0
B. 1
C. 3
D. 2
Lời giải:
Câu 17. Kim loại sắt phản ứng với lượng dư dung dịch chất nào sau đây tạo ra muối sắt(II)?
A. H2SO4 đặc, nóng.
B. HNO3 loãng.
C. H2SO4 loãng.
D. HNO3 đặc nóng.
Lời giải:
Câu 18. Cho các nội dung nhận định sau:
(a) Tính chất hoá học đặc trưng của kim loại là tính khử.
(b) Đồng (Cu) không khử được muối sắt (III) (Fe3+).
(c) Ăn mòn kim loại là một quá trình hoá học trong đó kim loại bị ăn mòn bởi các axit trong môi trường không khí.
(d) Để bảo vệ vỏ tàu biển làm bằng thép, người ta gắn vào mặt ngoài vỏ tàu (phần chìm trong nước biển) những khối kẽm.
Số nhận định đúng làA. 2.
B. 3.
C. 4.
D. 1.
Lời giải:
