Cu + AgNO3 → Cu(NO3)2 + Ag – VietJack.com
Chào mừng bạn đến với pgdgiolinhqt.edu.vn trong bài viết về Cu agno3 cuno32 ag chúng tôi sẽ chia sẻ kinh nghiệm chuyên sâu của mình cung cấp kiến thức chuyên sâu dành cho bạn.
Phản ứng Cu + AgNO3 → Cu(NO3)2 + Ag
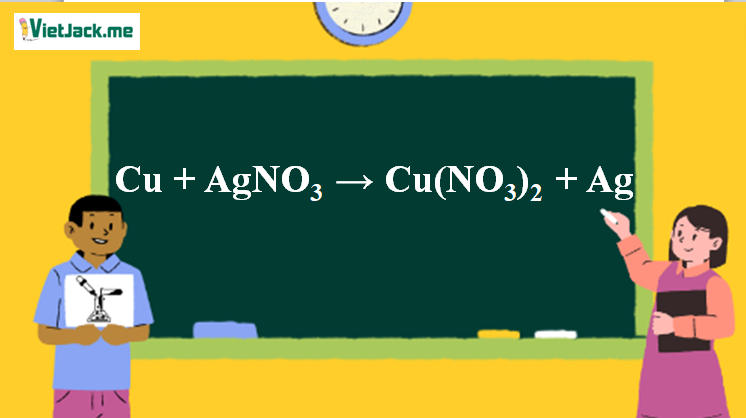
1. Phương trình phản ứng cho Cu tác dụng AgNO3
2. Cách tiến hành thí nghiệm đồng tác dụng bạc nitrat
Ngâm 1 đoạn dây đồng trong dung dịch Bạc nitrat.
3. Hiện tượng phản ứng Cu tác dụng AgNO3
Có kim loại màu xám ngoài dây đồng. Dung dịch ban đầu không màu chuyển dần sang màu xanh.
4. Điều kiện phản ứng kim loại tác dụng với muối xảy ra
Kim loại tham gia phản ứng phải mạnh hơn kim loại trong muối thì mới có thể đẩy kim loại đó ra khỏi dung dịch muối.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của Cu (Đồng)
Cu là kim loại khử được các ion kim loại đứng sau nó và trong dung dịch muối.
5.2. Bản chất của AgNO3 (Bạc nitrat)
AgNO3 mang tính chất hoá học của muối tác dụng được với kim loại với điều kiện kim loại mạnh hơn đẩy kim loại yếu hơn ra khỏi muối.
6. Tính chất hoá học của Cu
Là kim loại kém hoạt động, có tính khử yếu.
6.1. Tác dụng với phi kim
– Cu phản ứng với oxi khi đun nóng tạo CuO bảo vệ nên Cu không bị oxi hoá tiếp tục.
– Khi tiếp tục đun nóng tới (800-1000oC)
– Tác dụng với Cl2, Br2, S…
6.2. Tác dụng với axit
– Cu không tác dụng với dung dịch HCl, H2SO4 loãng.
– Khi có mặt oxi, Cu tác dụng với dung dịch HCl, nơi tiếp xúc giữa dung dịch axit với không khí.
2Cu + 4HCl + O2 → 2CuCl2 + 2 H2O
– Với HNO3, H2SO4 đặc :
Cu + 2H2SO4 đ → CuSO4 + SO2 + H2O
Cu + 4HNO3 đ → Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2O
6.3. Tác dụng với dung dịch muối
– Khử được ion kim loại đứng sau nó trong dung dịch muối.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
7. Mở rộng kiến thức về AgNO3
7.1. Tính chất vật lí & nhận biết
– Tính chất vật lí: Là chất rắn, có màu trắng, tan tốt trong nước, có nhiệt độ nóng chảy là 212oC.
– Nhận biết: Sử dụng muối NaCl, thu được kết tủa trắng
AgNO3 + NaCl →AgCl↓+ NaNO3
7.2. Tính chất hóa học
– Mang tính chất hóa học của muối
Tác dụng với muối
AgNO3 + NaCl →AgCl↓+ NaNO3
2AgNO3 + BaCl2 →2AgCl↓+ Ba(NO3)2
Tác dụng với kim loại:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Tác dụng với axit:
AgNO3 + HI → AgI ↓ + HNO3
Oxi hóa được muối sắt (II)
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
7.3. Điều chế
Bạc nitrat điều chế bằng cách hòa tan kim loại bạc trong dung dịch axit nitric.
3Ag + 4 HNO3(loãng) → 3AgNO3 + 2H2O + NO
3Ag + 6 HNO3(đặc, nóng) → 3AgNO3 + 3 H2O + 3NO2
8. Bài tập vận dụng liên quan
Câu 1. Tiến hành các thí nghiệm sau
(a) Ngâm lá đồng trong dung dịch AgNO3
(b) Ngâm lá kẽm trong dung dịch HCl loãng
(c) Ngâm lá nhôm trong dung dịch NaOH
(d) Ngâm lá sắt được cuốn dây đồng trong dung dịch NaOH
(e) Để một vật bằng gang ngoài không khí ẩm
(f) Ngâm một miếng đồng vào dung dịch Fe2(SO4)3
Số thí nghiệm xảy ra ăn mòn điện hóa là
A. 2
B. 1
C. 4
D. 3
Lời giải:
