CaCO3 + HCl → CaCl2 + CO2 + H2O – VietJack.com
Chào mừng bạn đến với pgdgiolinhqt.edu.vn trong bài viết về Cacl2 ra caco3 chúng tôi sẽ chia sẻ kinh nghiệm chuyên sâu của mình cung cấp kiến thức chuyên sâu dành cho bạn.
Phản ứng CaCO3 + HCl → CaCl2 + CO2 + H2O
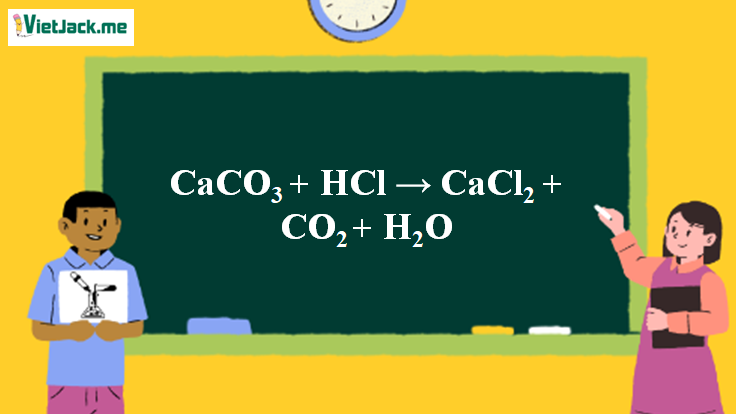
1. Phương trình phản ứng CaCO3 ra CO2
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
2. Điều kiện phản ứng CaCO3 ra CaCl2
Nhiệt độ thường
3. Đá vôi tác dụng với HCl có hiện tượng
Đá vôi tan dần và thấy có khí không màu thoát ra làm dung dịch sủi bọt.
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của CaCO3 (Canxi cacbonat)
CaCO3 mang đầy đủ tính chất hoá học của muối tác dụng được với các axit mạnh.
4.2. Bản chất của HCl (Axit clohidric)
HCl là một axit mạnh tác dụng được với muối cacbonat tạo muối mới và nước, đồng thời giải phóng khí cacbonic.
5. Mở rộng kiến thức về CaCO3
5.1. Tính chất vật lí & nhận biết
– Tính chất vật lí: Là chất rắn màu trắng, không tan trong nước.
– Nhận biết: sử dụng dung dịch axit HCl, thấy thoát ra khí không màu, không mùi:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
5.2. Tính chất hóa học
– Mang đầy đủ tính chất hóa học của muối:
Tác dụng với axit mạnh:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
Kém bền với nhiệt:
CaCO3 -to→ CaO + CO2
CaCO3 tan dần trong nước có hòa tan khí CO2.
CaCO3 + CO2 + H2O ⇆ Ca(HCO3)2
→ khi đun nóng:
Ca(HCO3)2 -to→ CaCO3↓ + CO2 + H2O
5.3. Điều chế
Đa số cacbonat canxi được sử dụng trong công nghiệp là được khai thác từ đá mỏ hoặc đá núi. Cacbonat canxi tinh khiết (ví dụ loại dùng làm thuốc hoặc dược phẩm), được điều chế từ nguồn đá mỏ (thường là cẩm thạch) hoặc nó có thể được tạo ra bằng cách cho khí cacbonic qua dung dịch canxi hidroxit.
Ca(OH)2 + CO2 → CaCO3↓ + H2O
6. Tính chất hóa học của HCl
Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
6.1. Tác dụng chất chỉ thị
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl-
6.2. Tác dụng với kim loại
Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Fe + 2HCl FeCl2 + H2
2Al + 6HCl 2AlCl3 + 3H2
Cu + HCl → không có phản ứng
6.3. Tác dụng với oxit bazo và bazo
Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl CuCl2 + H2 O
Fe2 O3 + 6HCl 2FeCl3 + 3H2 O
6.4. Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng để nhận biết gốc clorua )
Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2 MnCl2 + Cl + 2H2 O
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan ( cường thuỷ) có khả năng hoà tan được Au ( vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
7. Bài tập vận dụng
Câu 1. Cặp chất nào sau đây có thể tồn tại trong cùng một dung dịch
A. KCl và NaOH
B. AgNO3và NaCl
C. Ba(OH)2 và NaOH
D. CaCO3 và HCl
Lời giải:
Đáp án: A
